什么是CRO
一个制药公司一般需要花费5亿美元资金,用大概12到15年的时间才能让一个新药从试验室走入市场。在5000个临床前化合物中大约只有5个化合物可以进入临床试验,而这5个化合物中只有一个能被批准用于临床治疗病人,成为真正的药物。CRO公司业务范围包括化合物进入临床应用于人体试验等关键阶段;医疗器械的多次体外试验进入临床试验的人体阶段等重要任务;药品或者医疗器械上市后的进一步的安全性研究。在美国CRO已承接近60%的研发工作(不包含基础研究),在日本也已超过30%。CRO已经成为医药产业不可或缺的专业服务公司或机构。
* CRO - Contract Research Organization合同研究组织
EPS的CRO
EPS于1991年创立于日本东京,25年来秉承着“苟日新、日日新、又日新”的企业精神,砥砺奋进,现已拥有超过5000名(2016年9月30日)员工,在东京证券交易所主板上市,并积极进行海外拓展,服务范围覆盖全亚洲,成为亚洲最大的CRO公司,销售额超过5亿美元。除此之外,EPS还大力发展SMO,双管齐下全面服务临床开发。于此同时,相关专业服务齐头并进,其中CSO初具规模,形成了面向医药产业的一站式服务体系。
| * SMO - Site Management Organization现场管理组织 |
| * CSO - Contract Sales Organization合同销售组织 |
● |
上海日新医药发展有限公司 |
● |
苏州益新泰格医药科技有限公司 |
中国区的CRO(益新CRO)
益新CRO事业,秉承EPS集团在日本CRO行业积累下来的专业经验、管理经验,结合中国本地的行业特点,在中国区以数据管理、统计分析、EDC开发为优势,服务于医疗行业的I-IV期临床试验,包括医学撰写、临床监查、质量管理QA业务、药物安全警戒(PV)、注册事务及上市后PMS调查等CRO一站式服务。
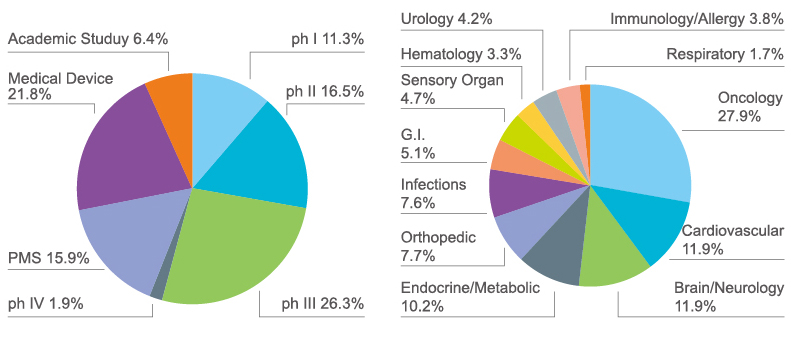
我们拥有超过150名专业员工,主要专业背景有临床医学、药学、临床药理和生物统计学,并且均接受过GCP和临床研究的良好培训,并与欧美、日本制药公司有着良好的沟通能力。依托集团优势,立足中国本土,面对亚太地区以及全球提供临床试验服务,实现高技术、高品质、高效率的专业服务。迄今为止,完成的和正在进行的有超过200个临床试验和研究。试验从 I 期到 IV 期,涉及肿瘤、心血管、脑和神经、免疫和过敏、眼科和抗感染等方面的领域。
我们将优化组合自身资源,并与本土CRO展开积极合作,提高团队的组织建设能力,做到服务产品化,为中国的医药产业做贡献。
具体业务范围
●药物和器械等注册服务及咨询●临床试验质量管理和稽查
●试验机构和研究者的筛选●临床试验设计 ●临床试验药物管理●临床试验监查 ●药物安全与药物警戒●临床试验项目管理 ●临床研究医学撰写●临床研究数据管理 ●临床研究EDC系统开发和使用●临床研究统计分析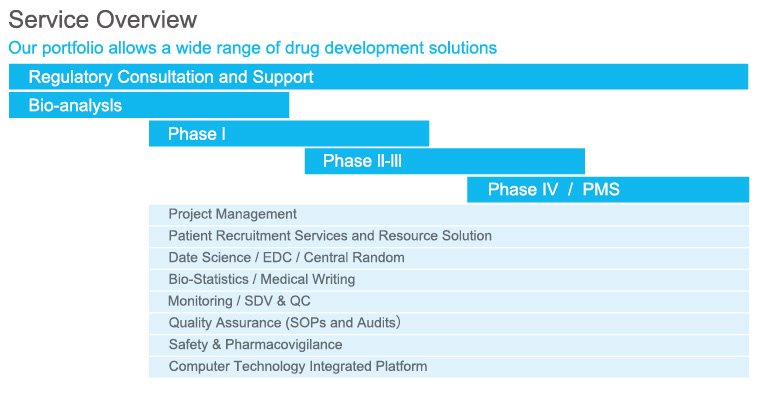
技术特长和管理优势
●在亚太区有25年的临床研究实践经验,在中国有15年以上的临床研究实践经验
●严格遵照GCP和CFDA的相关法规完成临床试验项目
●集团公司统一SOPs经过数十家跨国企业的系统稽查,拥有严格的品质管理体系及完善的操作规程
●提供以客户为导向的个性化服务
●具备有效的管理机制,在试验出现任何问题时都有危机处理备案
●在苏州拥有大规模的数据管理和统计解析专业团队,在北上广拥有专业的CRA、CRC团队
●训练有素的专业技术服务团队以确保项目在规定的周期内顺利实施和完成
●集团日本总部是东京证券交易所主板上市公司,在日本医疗健康行业拥有广泛的合作对象和良好的声誉
过去5年的开发经验
品质管理体系
| 质量管理体系 (QMS) |
●制定公司SOP及每个项目SOP。保证实施过程标准化、一致性及连续性 ●实施csv计算机系统验证,确保计算机系统自身的正确性 ●业务过程实施一般QC、重点QC |
|
| 信息安全管理体系 (ISMS) |
●制定信息安全管理目标,每年进行风垃评估 ●每季进行信息安全有效性检查,每年对供应链进行评审 |
|
| 内部审核 | ●针对具体项目每年进行自己检查 ●对公司的QMS、ISMS每年进行内部审核,发现的不符合项实施改善 ●并确认上一次审核的不符台项的改进情况 |
|
| 持续改进 | ●每年进行管理评审(目标完成、管理体系运行、资源管理、培训、
业务连续性计划等) ●提交改善方案,追踪实施,不断改进 |
对应领域●新药上市前临床试验 |
在中国的办事处分布在中国,我们的办事处分布在北京、成 都、广州、上海、沈阳、苏州、武汉、西 安等城市,为在中国的临床试验提供全方位的便捷服务。 |
其他专业服务以CRO为基础,利用中日双方的资源,
探索其它相关领域的专业服务。 |

