CROとは
製薬会社が5億ドルの資金、12~15年の歳月をかけてはじめて一つの新薬を実験室から市場に送り出せます。5,000の前臨床研究用化合物から臨床試験に入れるのは5個のみで、そのうち承認を受け臨床において病人の治療に用いられるのはたったの1個で、晴れて薬になるわけです。CRO業務は化合物が臨床における人体試験に用いる重要な段階に含まれます。また医療機器が数多くの体外試験を経て臨床試験において人体に用いる段階もそれに含まれます。薬品または医療機器が上市後も更なる安全性の研究が必要です。アメリカでは約60%の研究開発業務(基礎研究を含まず)はCROによって担い、日本でもその割合が既に30%を超えています。CROは医療業界に欠けてはならない専門サービス機関になっています。
* CRO - Contract Research Organization開発業務受託機関
EPSのCRO
EPSは1991年に東京で創業し、25年来、「顧客志向、ビジネス志向、人間志向」の行動指針を忠実に実践し、臨床試験のアウトソーシング化という時代の波に乗り、業界と共に発展してきました。2001年業界初としてジャスダックに上場し、2006年東京証券取引所1部に昇進しました。今日に至っては5,000名を超える社員を擁し、日本最大のCRO企業となり、業務範囲はSMO、CSOなど臨床試験関連事業にも広げ、またアジアパシフィック地域しいては全世界において国際同時臨床試験および登記申請業務の重要な一角を占めるようになっています。
| * SMO - Site Management Organization治験施設支援機関 |
| * CSO - Contract Sales Organization販売業務受託機関 |
● |
上海日新医薬発展有限公司 |
● |
蘇州益新泰格医薬科技有限公司 |
中国におけるCRO(益新のCRO)
益新のCRO事業は、EPSグループの日本CRO業界で蓄積した業務経験、管理手法を引き継ぎ、中国現地の特色と結び付け、データ管理、統計分析、EDC開発を特徴として、医療業界のI相からIV相までの臨床試験における報告書作成、臨床検査、品質管理QA業務、医薬品の安全管理・調査(PV)、登記業務および上市後のPMS調査などCROワンストップサービスを提供しています。
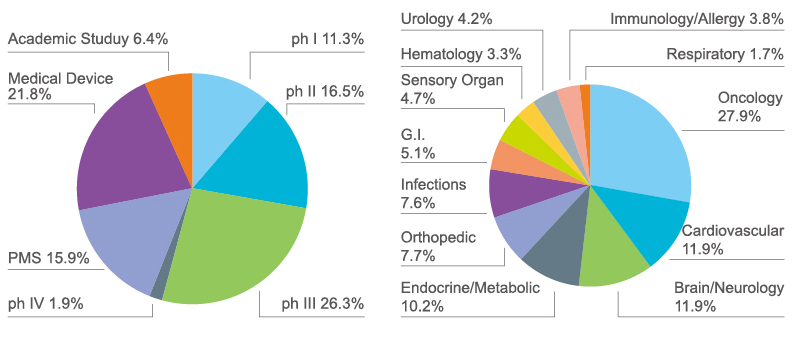
弊社は臨床医学、薬学、臨床薬理学および生物統計学など150名を超えるスペシャリストを擁し、みんながGCPと臨床研究の研修を受け、欧米や日本の製薬会社と良好なコミュニケーションを取ることが可能です。グループの優位性を生かしながら、中国本土に立脚し、ハイテック、高品質、高効率な臨床試験サービスをアジアパシフィック地域および全世界向けに提供しています。今日までには、200を超えるI相からIV相の臨床試験・研究を経験し、腫瘍、心血管、脳神経、免疫とアレルギー、眼科および抗感染症などの分野に及んでいます。
弊社は自身のリソースの最適化を図ると同時に、中国のCRO業界のパートナーとも積極的に協力しています。チームワークの構築、管理能力を高めながら、それぞれの特徴が発揮でき、お客様に最適なサービスを提供するとともに、中国医薬産業の発展に貢献しています。
業務範囲
●薬物と機器等の登録サービスおよびコンサルティング●臨床試験品質管理と監査
●試験機構と研究者のフィルタリング●臨床試験設計 ●臨床試験薬物管理●臨床試験監視 ●医薬品の安全管理・調査●臨床試験項目管理 ●症例報告書作成●臨床研究データ管理 ●臨床研究EDCシステムの開発と応用●臨床研究統計分析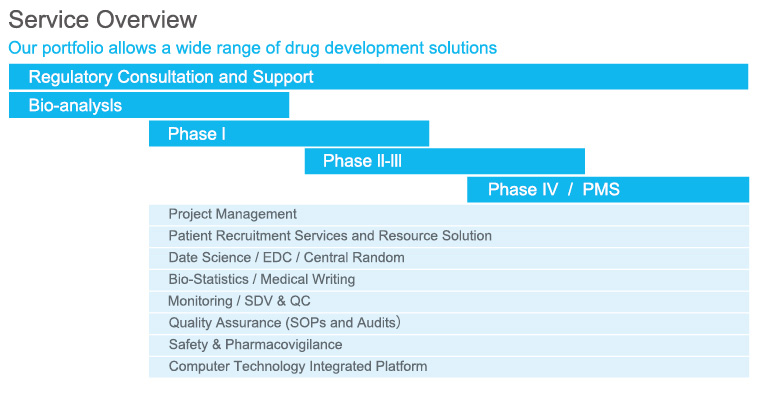
技術特徴と優位性
●アジアパシフィック地域において25年以上、中国においては15年以上の臨床試験実践の経験
●GCPとCFDA関連の法規を厳格に遵守していること
●グループ統一のSOPsがグローバル企業数十社のシステム監査を経験し、厳格な品質管理体制と健全なオペレーション規定を持っていること
●顧客志向の個性化サービス
●有効な管理体制を有し、いかなる問題にも代替案を用意していること
●蘇州に大規模データ管理と統計分析の専門チームを持ち、北京・上海・広州にも専門CRA、CRCチームを擁していること
●訓練の行き届いた専門チームが所定期間内に試験が順調に実施し完了されることを保障していること
●親会社グループが東京証券取引所1部に上場している企業であり、日本のヘルスケア産業において幅広いネットワークと良好な評判を有していること
過去5年間の開発経験
品質管理体系
| 品質管理体系 (QMS) |
●会社SOPおよび試験毎のSOPの策定。実施過程の標準化、一致性、連続性を保障 ●コンピュータシステムによるcsv検証の実施。コンピュータシステム自身の正確性を保障 ●業務過程において一般QC、重点QCを実施 |
|
| 情報安全管理体系 (ISMS) |
●情報安全管理目標の策定。毎年にリスク評価を実施 ●四半期毎に情報安全の有効性チェック、毎年にサプライチェーン評価を実施 |
|
| 内部検査 | ●案件毎に毎年自己検査を実施 ●毎年会社のQMS、ISMSにつき内部検査を実施、問題の発見と改善 ●前回検査の改善状況の確認 |
|
| 持続改善 | ●毎年管理評価(目標達成、管理体制の実施、リソース管理、研修、事業継続性計画など) ●改善方案の提出、トレース実施により絶えず改善 |
対応分野●新薬上市前の臨床試験 |
中国国内事業所分布北京、成都、広州、上海、瀋陽、蘇州、武漢、西安などの都市に事業所を配置しており、中国における臨床試験を全方位からサポートします。 |
その他専門サービスCROをベースとし、日中両国のリソースを生かしてその他関連分野における専門サービスの提供をも模索しています。例えば: |

